負染色法(Negative stain)是一種染色方法,常用于不透光液體標本的鏡檢。由于其染色處理過程并非針對菌體本身,故又稱“襯托染色法”、“間接染色法”。在負染色法中,標本不需要熱固定,細胞不會因為化學藥物的影響而變形,對于不易染色的細菌或病毒也能觀察。
負染色是一種容易,快速,定性的方法,常用于檢查分離的細胞器,大分子和病毒在EM水平的結構。但是,該方法不能夠對樣品進行高分辨率檢測 - 這在技術上更為復雜的快速冷凍。另外,因為負染色涉及沉積重原子,容易造成結構假象,球形或圓柱形結構的假象是非常常見的。然而,負染非常有用,不需要過于昂貴的技術。

樣品應懸浮在合適的緩沖液(如10 mM HEPES或PIPES)中,1%乙酸銨或蒸餾水中。 最好不要使用磷酸鹽緩沖液或PBS,因為它們可能會污染網格,否則會導致染色后必須清洗的鹽殘留物,造成襯度的損失。 尤其是,鈾酰鹽與磷酸根離子發生反應,產生細微的結晶沉淀,使沉淀物變得模糊。 [鈾離子的沉淀磷酸根離子也是在使用TEM的樣品處理過程中使用乙酸鈾酰作的潛在問題。】
MRC實驗室Protocol:
所需材料
5%乙酸鈾酯在二水合物中
碳涂層電鍍網格
自鎖/鎖定鑷子
100ul PCR管
發光放電器
清潔玻璃片和培養皿
Whatman紙,石蠟膜
相同緩沖液中的蛋白質和脂質體
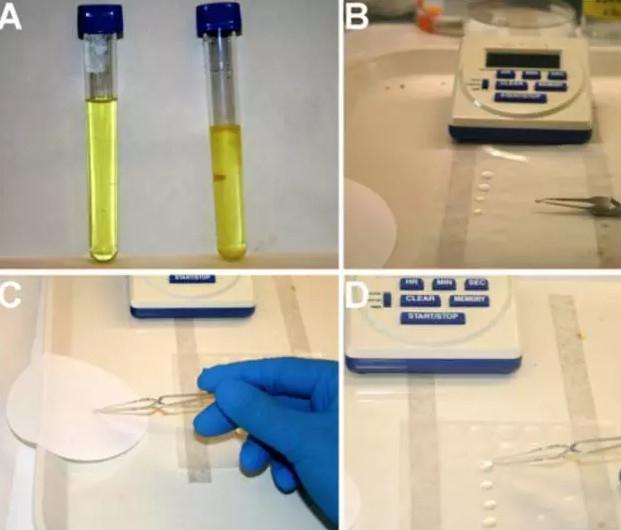
準備蛋白質,緩沖液,管和網格。將網格放置在清潔的顯微鏡載玻片上。在實驗室工作臺上貼下干凈的石蠟膜;將任何一面浸濕紙(盡量減少干燥)。
在PCR管中混合蛋白質和脂質。總體積將取決于您必須使用多少蛋白質。通常我混合至少20 ul;否則蒸發會大大改變鹽含量。
輝光放電:在真空室內放置帶有柵格的頂部(碳朝上),并拉動真空和輝光放電。如果不使用自動定時器,輝光放電30-60秒。排空后,將其置于培養皿中并返回實驗室。如果沒有可用的發光放電器,則可以省略此步驟。然而,結果不會那么干凈(較少的蛋白質會綁定,也可能更多地在網格上)。
將UrAc(每次20-40μl)滴入Parafilm - 每個樣品兩滴。在染色方案中,有一塊(折疊)Whatman紙用于吸收多余的污漬和洗滌網格緩沖液。還有另一塊Whatman,標有貼在其上的染色網格。
在夾鉗中握住網格。將6ul蛋白質/脂質溶液移至網格上。 20-45秒后,將緩沖液蛋白溶液印跡到Whatman紙上,接觸第一次UrAc滴,立即去除多余的污漬,接觸第二次UrAc滴。等待10-30秒,然后去除UrAc(注意吸除鑷子中殘留的液體)。然后可以通過接觸一滴緩沖液來清洗網格,并將其過量吸收。將網格放在標簽的Whatman紙上
允許網格干燥幾分鐘,然后放在網格框(注釋位置/ ID在實驗室書)。網格可以立即可視化,通常可以穩定數月或數年。
背景/評論
負染是一種非常快速,簡便的方法,可視化蛋白質,脂質,DNA - 任何大分子復合物。對于較大的蛋白質,復合物或連續寡聚體(例如肽或淀粉樣蛋白纖維,盡管單個亞基非常小,可以容易地可視化)是有用的。理論上最大分辨率的負染色為7A 這幾乎和cryo-EM一樣好,而且要容易得多。更典型的分辨率是15-30A通常有可能可視化數百kD的復合物(NB:簡單的計算和經驗表明,不可能看到單獨的蛋白質,或者在我手中,GroEL 14mers(840kD)或網格蛋白三糖(600kD)小于200kD的復合物,可以在良好的網格上制作,但HSP60單體不能)。然而,負染色的主要缺點是蛋白質固定在低pH,高離子強度的乳液或鈾離子層中。這并不一定會對所有的蛋白質產生重大的瑕疵(對于那些已經被cryoEM和負染所觀察到的那些蛋白質,幾乎沒有假象),但是基本上對蛋白質的影響是未知的。脂質體或脂質管傾向于塌陷,可能來自干燥期間的高離子強度。
UrAc的替代染色劑是磷酸鎢酸或PTA。這可以在diH2O中達到2%,然后pH值達到7.PTA的優點是pH值更為生理,對于某些事物,分辨率可能更大;缺點是對比度較低,我經常遇到大染色水晶的問題,因此很難找到網格的染色區域。但它是一個很好的控制。如果結構在PTA和UrAc兩者中看起來相同,那么它們不太可能是染色偽像。
操作方法:
滴染法:一般現將樣品用拉長的毛細吸管一滴在被膜的載網上,用濾紙在載網上吸去多余的樣品,使樣品在載網上僅有一層水膜而無液滴存在。在水膜未干時,再加一滴復染液在銅網上,然后用濾紙靠在載網變上吸去多余的染液,這是常規的負染方法。由于病毒在液滴的邊緣分布較多,上訴方法可能造成較多的病毒丟失,改良的方法是用毛細管在載網中部加1-1.5mm直徑的一小滴病毒懸液。不用濾紙吸干而任其在自然狀態下稍干后加入一小滴染液,也不用濾紙吸干,令其自然趕走。染液的密度取決于液滴的量和它的濃度,應經試驗確定,此法對于一些濃度低的病毒樣品可能獲得較好的效果。
漂浮法:現將需負染的樣品滴幾滴在干凈的載玻片上,再將有支持膜的載網漂浮在樣品液滴上以沾取樣品,用濾紙吸干樣品余液使樣品在載網上僅有一薄層液膜,在樣品未干時即加一滴復染液的銅網上,用濾紙吸干多余的染液即可。也可在磷鎢酸染液液滴中加入少許提純的病毒混勻,講有膜的銅網漂浮在液面上沾取有病毒的染液,用濾紙靠在銅網吸干。
噴霧法:將樣品與染液混合,用特制的噴霧器將混合液噴灑在有膜的載網上。這種方法的優點是樣品在載網上的分布十分均勻,但需要特殊的設備,故較少采用。而且染液和樣品消耗量較大,又易造成病毒的擴散。
負染的時機十分重要,一般不應再載網上的樣品完全干了之后,也不應該在載網上尚有肉眼可見的水珠時著手染色。應該在用濾紙吸干載網上的樣品液滴,肉眼看不見殘液,又未干燥時滴加染液。
提純的病毒在負染時最好進行1:10-1:100倍的稀釋,炫富病毒的緩沖液應盡可能稀一些,叫弄的緩沖液會使載網上產生許多鹽類的結晶而影響圖像的質量。緩沖液較濃時,宜先用雙爭輝稀釋。
復燃用的載網支持膜(有時是碳膜),有時因疏水性的影響沾樣后會形成一個球形液珠,用濾紙一吸即全部吸光,樣品難以附著在支持膜上,遇到這種情況,需要離子濺射儀對載網進行沁水處理,改善支持膜的親水性
復燃中常遇到顆粒懸滴樣品的凝集現象,即生物樣品與染色劑形成電子致密的團塊,致使無法觀察超微結構。這種現象是由多種因素引起的,除了上訴支持膜疏水性影響外,還可能是懸液濃度過大,懸液中細胞碎片過多,懸液PH值不適等,可以通過對樣品稀釋,驚醒2000-5000rpm離心和調節懸液PH值到中興或偏酸性來解決。
懸液顆粒分散性差也可以用分散劑來加以解決
用0.005-0.05%牛血清白蛋白(BSA)加入提純的病毒中,加入量無嚴格規定,一般0.5ml樣品中加3-4滴即可,如效果不好可適當怎額增加,也可直接用0.01%BSA作為離心沉淀物的懸浮液。
將桿菌肽粉末按30-50ug/ml的濃度用蒸餾水配成溶液,用來稀釋離心沉淀的顆粒標本或按適當比例加到需負染的樣品中取,也可以按樣品,磷鎢酸和桿菌肽等量混合在滴到載網上,吸干即可觀察。
除上訴兩種分散劑外,還有人采用甘油丙二醇作為分散劑,也有人用1%二甲基亞砜(DMSO)加到染液里加強染液的穿透力和擴散作用,最近有人用十八(碳)烷的單分子層作為濕潤劑,使不易染色的某些生物大恩自以著色。
某些病毒對復染色液較為敏感,負染色液會破壞形態結構,遇到這種情況,除改用其它種類的復染色液之外,還可在負染先用1%的戊二醛按比例與樣品懸液混合,固定15分鐘。或者在沾樣后,將載網票在0.1%的戊二醛液滴上進行固定。也可以用四氧化e整齊xun蒸固定然后在做負染。
滴樣后用雙蒸水進行適當清洗,可以有效地改善負染效果。尤其是使用醋酸鈾做負染色液時,應盡量洗掉樣品中的緩沖液鹽、組織汁液等,以免與負染液反應產生沉淀。經固定后的樣品必須經過清晰,對直接取自蔗糖密度梯度或氯化銫密度梯度離心沉淀帶的炫富樣品,沾取后雙蒸水適當清洗后,就可直接負染觀察。
觀察負染色的生物樣品時,電鏡應使用最小的武警光瀾,以增大反差。加速電壓可稍高一些,也增加電子的穿透能力。盡量避免電子束的長時間照射,一般在 3-4萬倍的放大倍率下照像,均可獲得高分辨率的電鏡圖像。
- 上一篇:我國化學試劑行業市場現狀分析
- 下一篇:化工產品的安全儲存須知